蛋白质-抑制剂的相互作用模式对于理性药物设计至关重要。低水溶性小分子的复合物晶体结构很难获取,而中等亲和力的药物先导化合物又常处于核磁中等交换这一极限条件,结合界面处的谱峰严重增宽甚至消失。针对这一难题,中国科学技术大学微尺度物质科学国家研究中心、生命科学学院施蕴渝院士/吴季辉教授团队的阮科副教授发展了一项新方法,近期以“Ligand Proton Pseudocontact Shifts Determined from Paramagnetic Relaxation Dispersion in the Limit of NMR Intermediate Exchange”为题发表在《Journal of Physical Chemistry Letters》上。
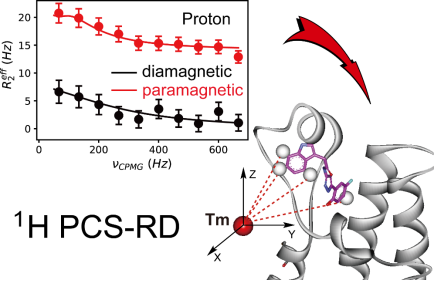
通过向小分子溶液中添加低比例的顺磁标记蛋白质,利用弛豫弥散(relaxation dispersion, RD)实验获取配基结合态的氢原子赝接触位移(pseudocontact shifts, PCS),其中富含距离与方向的重要结构信息,我们将该新方法命名为1H PCS-RD。通过基于片段的方法,我们发现了BRM bromo结构域的一个低水溶性药物先导化合物,进而将这一新方法成功应用于鉴定符合实验约束的结合态构象。这是在我们先前发表的氟19方法上(Gao et al., Angew. Chem. Int. Ed. 2017)的又一重要拓展,由于氢原子在类药分子中是普遍存在的,该方法有望在基于结构的药物先导化合物发现领域有更为广泛的应用前景。
论文的共同第一作者是中国科学技术大学博士生徐涤非、清华大学博士生李彬和合肥物质科学研究院高佳助理研究员。中国科大的马荣声、新加坡国立大学的杨代文教授和中国科大的阮科副教授是本项研究的共通讯作者。该工作得到了中科院先导项目、国家重点研发项目、973和国家自然科学基金委、中央高校基本科研业务费专项资金的资助。该工作还得到了国家蛋白质科学中心(上海)、中国科学院强磁场科学中心、北京大学国家大型科学仪器中心北京核磁共振中心的仪器和技术支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.jpclett.8b01443
