中国科学技术大学蔡刚教授课题组利用冷冻电镜技术,解析了染色质重塑SWI/SNF与INO80复合体及其不同核小体结合状态复合物的三维结构,揭示了SWI/SNF与INO80复合体共有的肌动蛋白(Actin)和核肌动蛋白相关蛋白(Arps)组成的Actin/Arp模块作为构象调控的分子开关,调控核小体结合及可能调节重塑核小体活性的分子机制;相关研究成果近日分别在国际权威杂志《Protein & Cell》和《Journal of Molecular Cell Biology》上发表。
染色质结构的调控对于真核生物的基因转录、细胞周期发展、DNA复制、重组和损伤修复具有至关重要的意义。催化染色质结构改变的酶,包括组蛋白修饰(乙酰化、甲基化、磷酸化、泛素化以及类泛素化等)和染色质重塑(ATP依赖性的DNA移位酶),通常组装成多亚基的复合体来发挥功能。多个组蛋白修饰和染色质重塑复合体,都含有肌动蛋白(Actin)和肌动蛋白相关蛋白(Arps)组成的Actin/Arp模块,如SWI/SNF (高等生物中的BAF)、INO80、SWR1和NuA4/TIP60等。目前对这些复杂复合体各个亚基在复合体中的定位、及其在复合体组装和稳定中的贡献,以及如何重塑核小体结构的分子机制知之甚少。
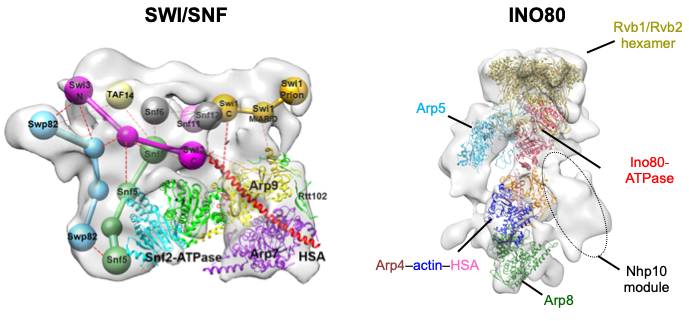
蔡刚教授课题组针对这些难题启动攻坚。经过大量系统尝试,克服了重重困难,分别获得了SWI/SNF与INO80复合体完整复合体的高质量生化制备和冷冻电镜三维结构,但是,分辨率受限于染色质重塑复合体显著的结构柔性,无法从结构上鉴定各个亚基的空间位置和相互作用。蔡刚研究组采取“庖丁解牛”的研究策略,通过细致比较完整复合体及其各个亚基缺失突变体的精细三维结构,首次阐明了SWI/SNF和INO80复合体的亚基组织架构和亚基间的相互作用,建立了各个亚基的生物学功能和复合体组装和功能调控的直接联系。
此外,蔡刚课题组解析了SWI/SNF催化核心亚复合体和INO80 Actin/Arp模块,及其结合核小体底物的不同重塑状态的精细三维结构,发现了SWI/SNF和INO80复合体共有的Actin/Arp模块首先结合核小体,通过Actin/Arp模块显著的构象变化,帮助核小体加载到催化核心的ATPase结构域。高度柔性的Actin/Arp模块不仅构成了染色质重塑复合体结合核小体的构象开关,而且有可能通过直接调节ATPase结构域的构象,调控着SWI/SNF和INO80染色质重塑的活性。
该成果对揭示染色质重塑复合体重塑核小体结构的分子机制,理解基因表达及其调控的分子机制,细胞增殖、发育及分化的机理具有重大意义;并有可能为新型肿瘤治疗药物的开发、干细胞分化与重新编程的改造奠定理论基础。
蔡刚实验室的博士研究生张智慧和张旋分别是两篇论文的第一作者,蔡刚教授和王雪娟研究员同为共同通讯作者。该项工作获得了基金委、科技部和合肥微尺度物质科学国家实验室的资助,此外,还得到了中科院生物物理所生物成像中心的仪器和技术支持。
两篇文章链接分别为:
https://link.springer.com/article/10.1007%2Fs13238-018-0524-9
https://academic.oup.com/jmcb/advance-article-abstract/doi/10.1093/jmcb/mjy062/5156286
生命科学学院
