Ephrin-Eph信号通路通过调节下游Rho GTPase的活性调控细胞骨架动态变化,在神经发育及信号转导、细胞极性、细胞迁移、代谢平衡等过程发挥关键作用。Eph受体是酪氨酸蛋白激酶受体家族最大的分支,其可以招募多种Rho GTPase调节蛋白复合物(RhoGEF和RhoGAP)发挥功能。Ephexin(Eph-interacting exchange protein)家族蛋白是Ephrin-Eph通路下游重要的RhoGEF,负责激活Rho GTPase。编码Ephexin家族蛋白的基因的突变与多种神经系统疾病及肿瘤的发生发展密切相关。为了实现Rho GTPase时空尺度上的精准调控,Ephexin家族蛋白可以选择自抑制和激活的两种构象状态,但分子机制尚不明确。
近日,中国科学技术大学生命科学与医学部王朝教授课题组和上海交通大学Bio-X研究院朱金伟教授课题组合作在PNAS在线发表题为Double inhibition and activation mechanisms of Ephexin family RhoGEFs的研究论文,首次揭示了Ephexin家族RhoGEF双重自抑制及激活的分子机制。
本项工作发现Ephexin4 RhoGEF的自抑制包含两个部分:1)其羧基端的SH3-HC串联结构域能够与GEF酶活中心-DH-PH结构域相互作用,从而阻碍了RhoG的进入,抑制了催化反应;2)其氨基端的一段保守的多肽序列(IH多肽序列)也能结合到DH结构域上,抑制Ephexin4的酶活。
该工作运用结构生物学方法分别研究了Ephexin4的羧基端自抑制和双重自抑制的三维结构信息,详细阐明了Ephexin4自抑制的结构基础和分子机理(图1)。有趣的是,结构分析显示自抑制界面上关键残基(如R706)在肿瘤中发生突变(R706L),这一突变将打破自抑制构象,从而激活Ephexin4的酶活。生化实验也证实了这一结构分析(图1)。
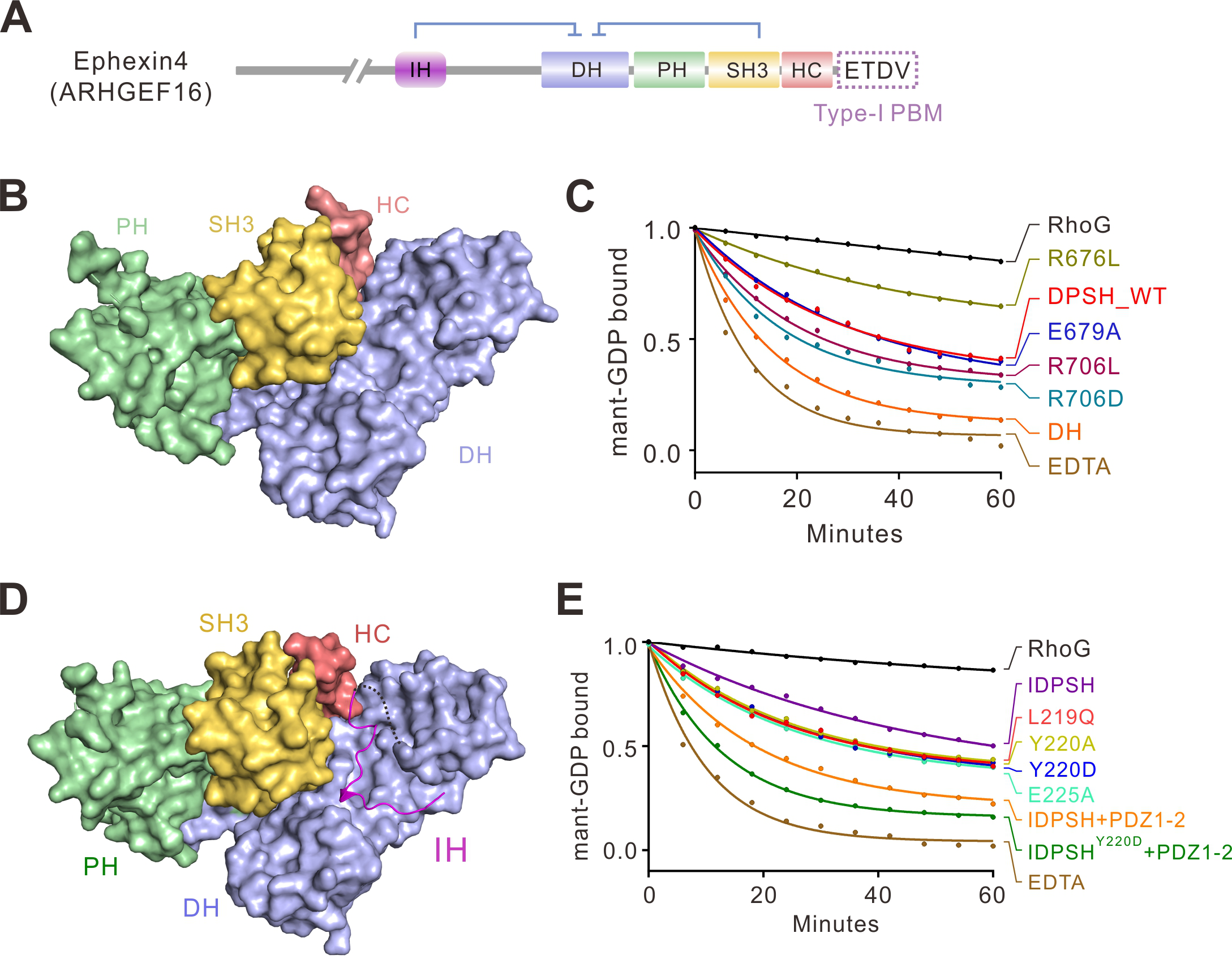
图1. Ephexin4的氨基端自抑制构象
本工作进一步探索了Ephexin4自抑制构象激活的可能机制。作者发现,DLG1或Tip1蛋白的PDZ结构域可以结合Ephexin4羧基末端的PDZ结合序列(PDZ-binding motif,PBM);这一相互作用能够有效的激活Ephexin4羧基端的自抑制。Ephexin家族蛋白氨基端的IH自抑制多肽序列“LY220Q”中的Tyr220据报道能够被Src等酪氨酸激酶磷酸化。结构分析及生化实验证实这一磷酸化将大大降低抑制多肽与DH结构域的相互作用,从而打开自抑制构象(图2)。重要的是,上述两种Ephexin4的激活机制在细胞里也是同样的工作机制。进一步研究表明,Ephexin家族其他蛋白以及另一个RhoG-GEF-SGEF也采用同样的自抑制模式(图2)。
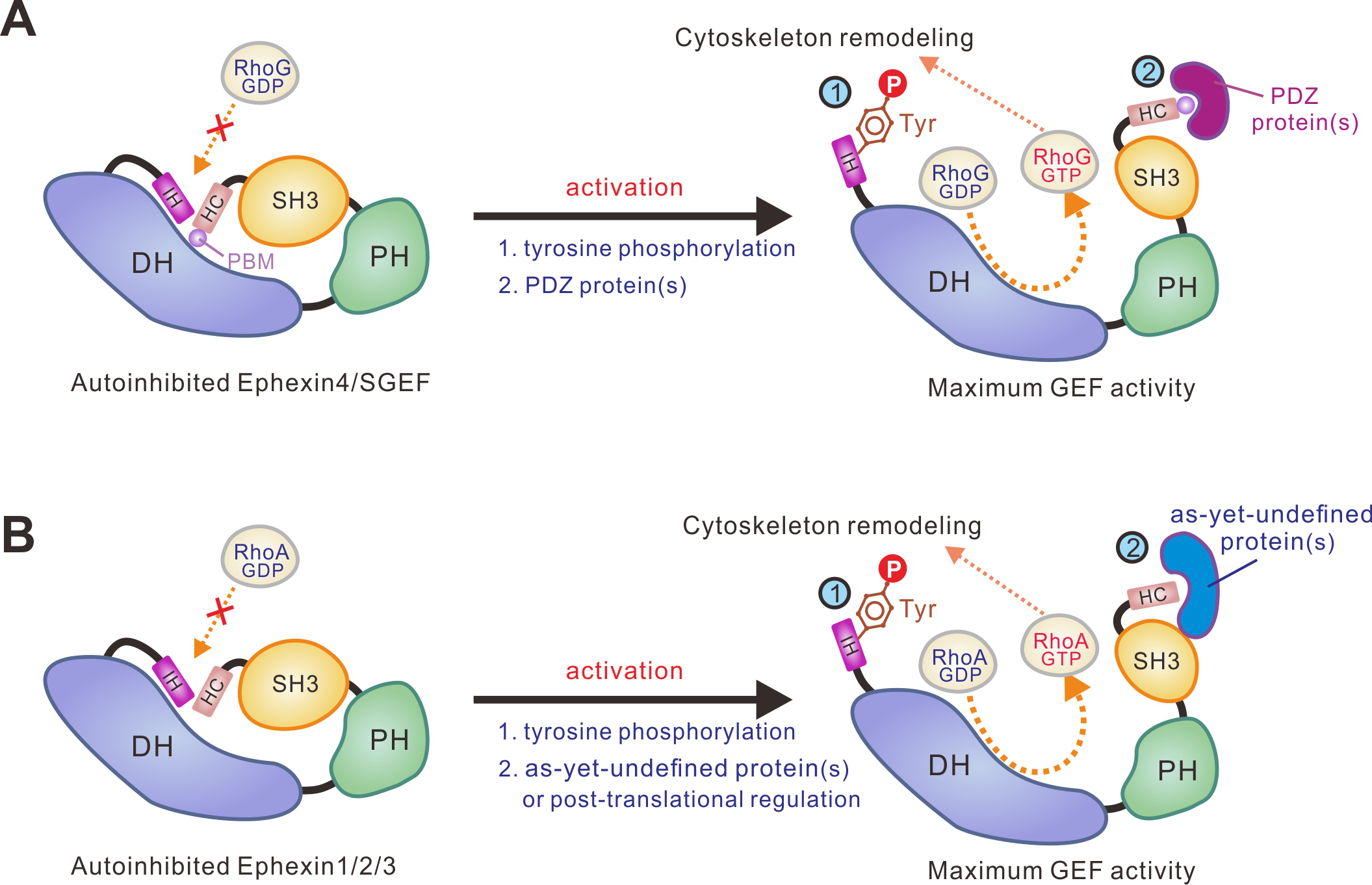
图2. Ephexin家族RhoGEF双重自抑制和激活分子机制示意图
综上,本项工作通过综合运用结构生物学、生物化学和细胞生物学等方法,阐明了Ephexin家族蛋白双重自抑制和激活的分子机理,为相关神经系统疾病和肿瘤的发病机制提供了可靠的结构阐释,并为相关药物的开发提供了基础。
中国科学技术大学王朝教授以及上海交通大学朱金伟教授为论文的共同通讯作者,中国科学技术大学博士研究生张猛和上海交通大学助理研究员林霖为论文的共同第一作者。中国科学技术大学为文章第一单位。该研究工作获得了无膜细胞器与细胞动力学教育部重点实验室、微尺度国家研究中心、国家自然科学基金委、科技部等项目支持。
论文链接: https://doi.org/10.1073/pnas.2024465118
(无膜细胞器与细胞动力学教育部重点实验室、合肥微尺度物质科学国家研究中心、生命科学与医学部、科研部)
