2025年6月4日,中国科学技术大学生命科学与医学部黄成栋教授等团队在《Nature Structural & Molecular Biology》期刊发表题为《Remote On-Off Switching of Protein Activity by Intrinsically Disordered Region》的研究论文。该工作首次揭示:蛋白质中的固有无序区域(IDR)无需与功能结构域直接接触,即可通过调控构象熵,远程实现对蛋白活性的 “开关”控制。这一突破打破了“必须接触或发生结构变化才能调控”的传统认知,为新型分子开关的设计提供了全新思路。
本研究同步在Nature Structural & Molecular Biology发表Research Briefing专题解读,题为《How protein disorder turns internal dynamics into a long-range regulatory switch》。
IDR:蛋白质功能的“隐形操控器”
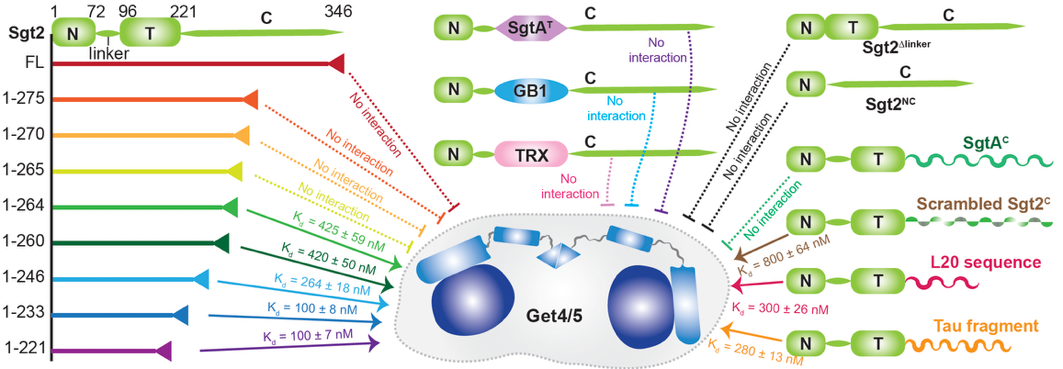
蛋白质的IDR广泛存在,却常因“缺乏稳定结构”而被视作“无用尾巴”。本研究以分子伴侣Sgt2为模型,利用高分辨率核磁共振(NMR)和生化手段,系统揭示了Sgt2的C端IDR能作为“双向熵调节器”,跨越150多个氨基酸远距离调控N端结构域的动态性与活性,从而按需切换蛋白对下游分子的结合能力。令人惊讶的是,该功能的“开—关”切换完全不依赖任何直接接触或瞬时相互作用,仅凭IDR对动态变化的远程调控即可实现 (图1)。

独立于中间结构域,IDR序列本身就是“开关密码”
进一步研究表明,Sgt2的自抑制作用与蛋白的中间结构域无关,而是由IDR特定的氨基酸序列决定 (图2)。只要改变IDR的序列,这种自抑制效果就会消失。这说明,IDR区域本身很可能是决定蛋白功能的核心元件,而非“进化残留”。
构象熵:蛋白质远程调控的新范式
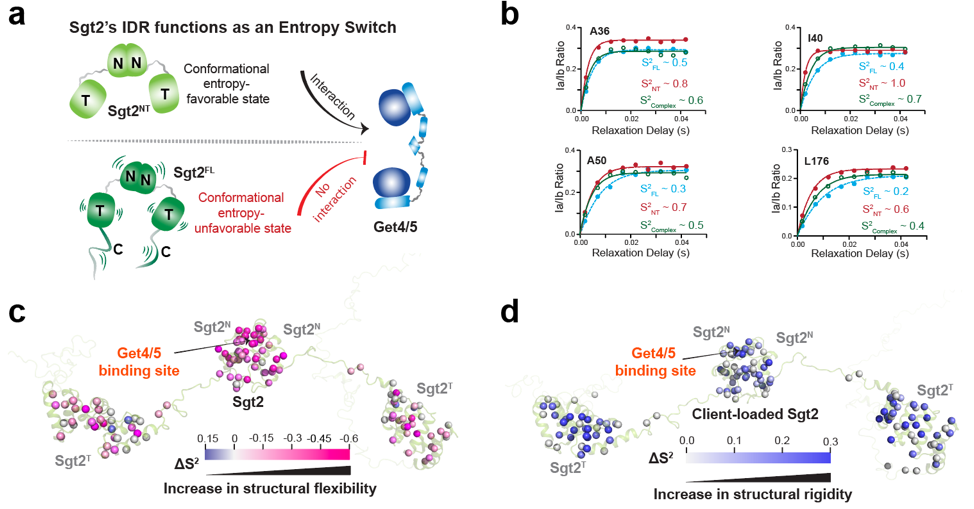
与经典的“构象变化”模型不同,本工作证实,Sgt2蛋白的自抑制和解锁过程完全建立在内部动力学变化(即构象熵)的调节上。IDR存在时,分子整体处于高度动态、低序参数(高熵)状态,功能域被“锁定”;而IDR被切除或底物结合后,分子变得刚性,活性被“解锁” (图3)。这揭示了“动态熵信号”作为蛋白远程调控的新范式,有望推广到更多蛋白系统中。
展望
该工作也充分展现了液体NMR技术在解析蛋白动态与功能关系上的独特优势。这一发现不仅拓展了蛋白质调控机制的认知,更为未来开发高效、可控的新型蛋白分子开关提供了理论基础。
本研究由中国科学技术大学博士生季拓为第一作者,黄成栋、王育才、王朝教授为共同通讯作者。项目得到国家自然科学基金委员会、科技部、无膜细胞器与细胞动力学教育部重点实验室、合肥综合性国家科学中心大健康研究院等机构资助,部分实验在中科院合肥物质科学研究院强磁场中心完成。
原文链接:https://www.nature.com/articles/s41594-025-01585-7
