能量摄入与消耗的动态平衡是生物生存的核心策略。当食物匮乏时,哺乳动物常通过蛰伏(torpor)——一种以低代谢率、低体温和低心率为特征的适应性状态——来保存能量。蛰伏现象在自然界广泛存在(如冬眠动物),其潜在机制对临床危重症保护、器官移植乃至太空探索具有重要意义。然而,大脑如何主动协调体温下降、心率减缓、代谢抑制等生理变化,以及这些变化间的因果关系,始终是未解之谜。脑干作为连接自主神经系统的关键枢纽,其腹外侧延髓(ventrolateral medulla, VLM)中的儿茶酚胺能神经元(CA神经元)已被报道参与心血管、体温及能量代谢调控,但其在蛰伏中的作用尚不清楚。
2025年7月1日,中国科学技术大学生医部免疫应答与免疫治疗全国重点实验室/第一附属医院血液科占成教授团队,在Nature Communications杂志上发表题为“Brainstem catecholaminergic neurons induce torpor during fasting by orchestrating cardiovascular and thermoregulation changes”的研究论文。该研究首次发现VLM-CA神经元是禁食诱导蛰伏的核心调控枢纽,激活此类神经元可重现自然蛰伏的关键生理特征,心率下降先于体温降低的时序关系,并解析出VLM-CA→迷走神经背核(DMV)和VLM-CA→内侧视前区(MPA)两条功能分化的神经环路。
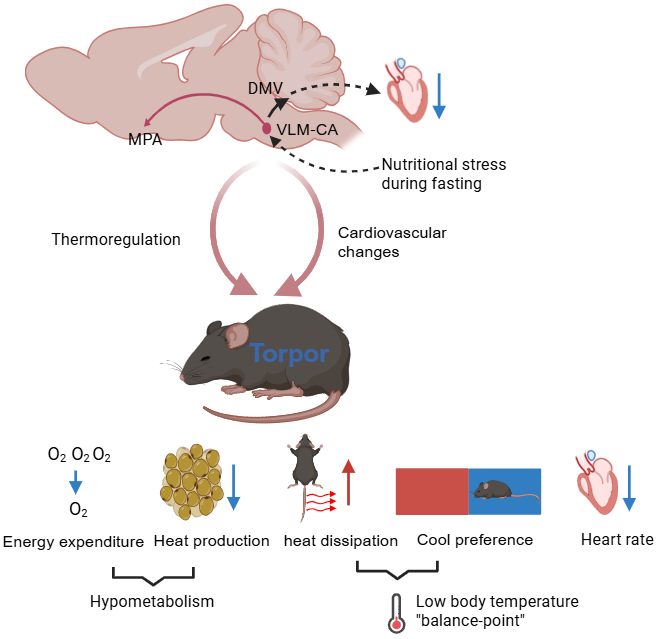
VLM-CA神经元调控torpor的模式图
研究团队发现在禁食诱导蛰伏的早期阶段,小鼠腹外侧延髓吻侧与中间区的儿茶酚胺能神经元(VLM-CA)活性显著增强。为验证其必要性,采用化学遗传学方法特异性抑制小鼠的VLM-CA神经元活性,导致小鼠在禁食条件下诱导蛰伏的能力出现显著降低。而在非禁食小鼠中激活VLM-CA神经元后,心率迅速下降,在2分钟内从730±19 bpm骤降至345±26 bpm,并伴随窦性心律不齐及心跳暂停,且体温下降则相对滞后于心率变化。这种“心率先降、体温后降”的时序关系与自然蛰伏动物一致。此外,激活VLM-CA神经元还显著抑制代谢率(耗氧量下降32%),降低棕色脂肪产热(iBAT温度下降约4℃),减少活动量。这些结果提示VLM-CA神经元在蛰伏诱导与维持中发挥关键作用。
通过病毒示踪与光遗传学技术,研究团队揭示了VLM-CA→DVC环路通过兴奋迷走神经背核(DMV)神经元,介导心率的急剧下降,体温的缓慢下降。而激活VLM-CA→MPA环路则抑制产热,维持低温状态。在关键发现方面,研究团队还证实,β受体激动剂(异丙肾上腺素)能够逆转心率减缓和体温下降,这一发现表明心率变化与体温调节之间的紧密联系,证实心率下降可能是体温降低的关键驱动力,二者协同促进蛰伏维持。
达乌尔黄鼠(Spermophilus dauricus)是一种典型的冬眠动物,研究团队发现达乌尔黄鼠也具有VLM-CA神经元,且在冬眠起始前(10月)特异性激活,这一结果提示VLM-CA神经元在跨物种冬眠中可能具有保守功能。
本研究揭示了VLM-CA神经元在禁食诱导蛰伏中的关键作用,首次表明这些神经元不仅在诱导与维持蛰伏过程中起关键作用,还能通过人为激活诱导出类似冬眠的生理状态。研究为理解蛰伏的神经调控机制提供了新的理论框架,同时为人工诱导保护性低代谢(如器官移植前预处理)开辟了新途径。未来的研究应聚焦于解析VLM-CA神经回路的精细功能,尤其通过跨物种比较(如冬眠动物)验证其在自然冬眠中的保守性机制。此外,如何通过调控这些神经元改善能量代谢,也是值得深入探讨的重要方向。
中国科学技术大学生医部免疫应答与免疫治疗全国重点实验室,第一附属医院血液科的占成教授为本文通讯作者;课题组博士毕业生程明秀、博士生王美琪及技术员王亮为该研究工作的共同第一作者。本研究的顺利开展得益于多位专家学者的支持与指导,包括:浙江大学李浩洪教授、北京大学王世强教授、北京生命科学研究所曹鹏教授、加拿大加文医学研究所石雁川教授等。该研究得到国家自然科学基金委、免疫全重实验室培育基金,以及国家科技创新2030重大项目等项目支持。
