2025年7月17日,中国科学技术大学生命科学与医学部张凯铭/李珊珊课题组在Nature Communications杂志发表题为“The PAZ Pocket and Dimerization Drive CpAgo's Guide-Independent and DNA-Guided Dual Catalysis”的文章。该研究系统解析了一种来自细菌(Clostridium perfringens)的“多面手”核酸酶——CpAgo,发现其同时具备引导链依赖与非依赖的双重切割功能,不仅能精准地识别并降解外源DNA,还能直接攻击结构复杂的RNA。这项发现为细菌抵御外来基因入侵提供了全新视角,也为合成生物学与新型抗菌策略开辟了新的研究方向。

双重机制,精准应对“入侵者”
在细菌与噬菌体的攻防战中,如何精准识别并高效清除外来基因,是一项决定生死的能力。Argonaute蛋白(Ago)作为广泛存在于原核和真核生物中的“分子剪刀”,通常通过引导链(guide DNA或guide RNA)定位目标核酸,完成特异性切割。传统的原核Argonaute(pAgo)大多依赖这种“导航”系统执行功能。而本研究通过体内和体外实验揭示,CpAgo不仅具备传统的引导链依赖切割能力(guide-dependent),还能在缺乏引导链的情况下,直接识别并降解外源DNA与结构复杂的RNA(如SL5结构),表现出极为罕见的引导链非依赖(guide-independent)活性。这种兼具精准与广谱的双重机制,使CpAgo在天然抗外来核酸侵染中发挥潜在的“多面手”角色。
关键结构揭秘,精准激活剪切功能
为了揭示CpAgo功能的结构基础,研究团队借助冷冻电镜技术成功解析了多种CpAgo二元和三元复合物的三维结构。结果表明,CpAgo只有在同时结合了引导链和靶标链后,才会组装成具有催化活性的“二聚体”。这个激活过程就像给剪刀装上了刀片——精准又强大。
令人惊喜的是,研究还发现了一个前所未知的PAZ核苷酸结合口袋,这一结构与CpAgo的引导链依赖与非依赖降解能力都密切相关。通过结构引导的突变分析,研究人员进一步确认PAZ区域中的D80与D249两个酸性残基是非依赖模式降解功能的关键位点。同时,这些突变还显著提高了CpAgo对RNA的亲和力,从而偏向选择RNA作为切割靶标。
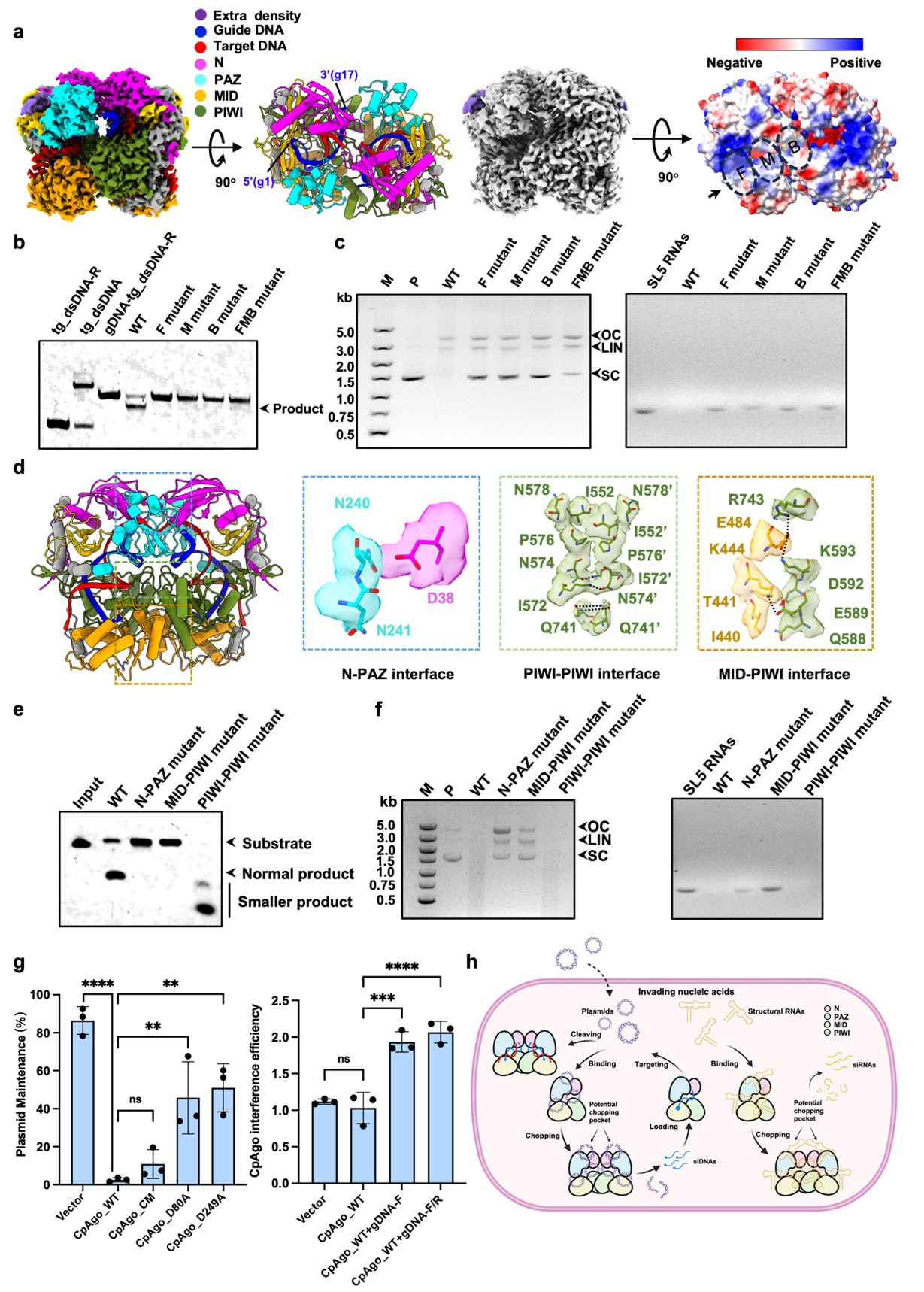
图注:a. CpAgo-gDNA-tg_dsDNA三元复合物的冷冻电镜结构,揭示了PAZ结构域中的一个新型核苷酸结合口袋(extra density);b. PAZ口袋中关键正电荷残基突变会削弱CpAgo对靶DNA的引导链依赖性降解活性;c. 同样的突变也损害了CpAgo在无引导链条件下对DNA和RNA的非特异性降解能力;d. CpAgo功能性二聚体的界面结构特征;e. 破坏二聚化界面显著削弱CpAgo的引导链依赖性靶DNA切割能力;f. 二聚体界面突变同样影响CpAgo的无引导链降解活性;g. 体内实验证实CpAgo具有无需引导链的质粒清除能力以及gDNA依赖的质粒干扰功能;h. CpAgo抵御外源核酸入侵的工作模型图。
潜力无限,应用广泛
CpAgo来源于一种厌氧菌——产气荚膜梭菌,具有在中温条件下高效工作的优势。研究人员表示,这种蛋白的发现不仅拓宽了人们对细菌免疫系统的理解,也为未来开发新型基因编辑工具、抗病毒策略提供了全新思路。
正如作者在文中所讲:“CpAgo像是一把智能剪刀,它的精准性和灵活性为合成生物学开辟了更多可能。”
该研究工作获得了国家自然科学基金委、科技部、中国科学院先导等项目的资助,以及获得了细胞动力学教育部重点实验室、中国科大冷冻电镜中心及附一院的大力支持。中国科学技术大学生医部博士研究生刘雨婵为第一作者,中国科大谢文兵教授团队在该工作上给予了重要帮助。李珊珊副教授和张凯铭教授为共同通讯作者。
原文链接: https://www.nature.com/articles/s41467-025-61926-4#Ack1
