RNA不仅是遗传信息的载体,还通过复杂的三维结构参与催化与调控。在诸多RNA分子中,环状RNA(circRNA) 以其闭合拓扑结构展现出高稳定性、低免疫原性和持久功能,因此在疫苗、核酸药物和合成生物学等领域备受关注。然而,高效、规模化地制备高纯度circRNA仍然是亟待突破的难题。利用核酶(ribozyme)自催化反应的PIE(permuted intron-exon)系统是目前较为高效的策略,其中源自T4噬菌体的td内含子(T4 td intron)是应用最广的工具之一。但其环化的分子机制与结构基础一直缺乏清晰解析。
2025年11月18日,中国科学技术大学生命科学与医学部张凯铭/李珊珊课题组在Nature Catalysis杂志发表研究论文“Structural Insights and Engineering of T4 td Intron for Improved RNA Circularization”。本研究是课题组在核酶领域的又一重要研究突破(Nature 2021; PNAS 2022; Nucleic Acids Research 2023; Nature Communications 2023; Nature 2025)。

本研究利用冷冻电镜(cryo-EM)分别解析了T4 td内含子在线性态与环状态下的高分辨率结构,揭示了RNA环化过程中关键的结构重排与金属离子作用机制:在环化过程中,催化核心碱基重新配对形成如U14-G37的新互作,同时P1ext螺旋结构消失;不同金属离子在环化前后位置发生显著变化,为环状拓扑的稳定提供关键支撑;整体机制与I型核酶自剪接的第一步高度相似。
基于上述的结构信息,研究人员鉴定出G37等关键核苷酸位点,并通过突变(U14C、G37A)显著提高了线性内含子的环化效率。将优化突变引入T4 td-PIE系统后,在多种温度条件下均显著提升了目标RNA(如POLR2A、EGFP)的环化效率。更进一步,与 Anabaena-PIE系统 和 TRIC-V2策略等先进平台的对比显示,优化后的T4 td-PIE在效率与产物纯度上均具备优势。这一成果展示了结构生物学驱动RNA工程优化的强大潜力,为大规模、高纯度circRNA生产提供了新路径。
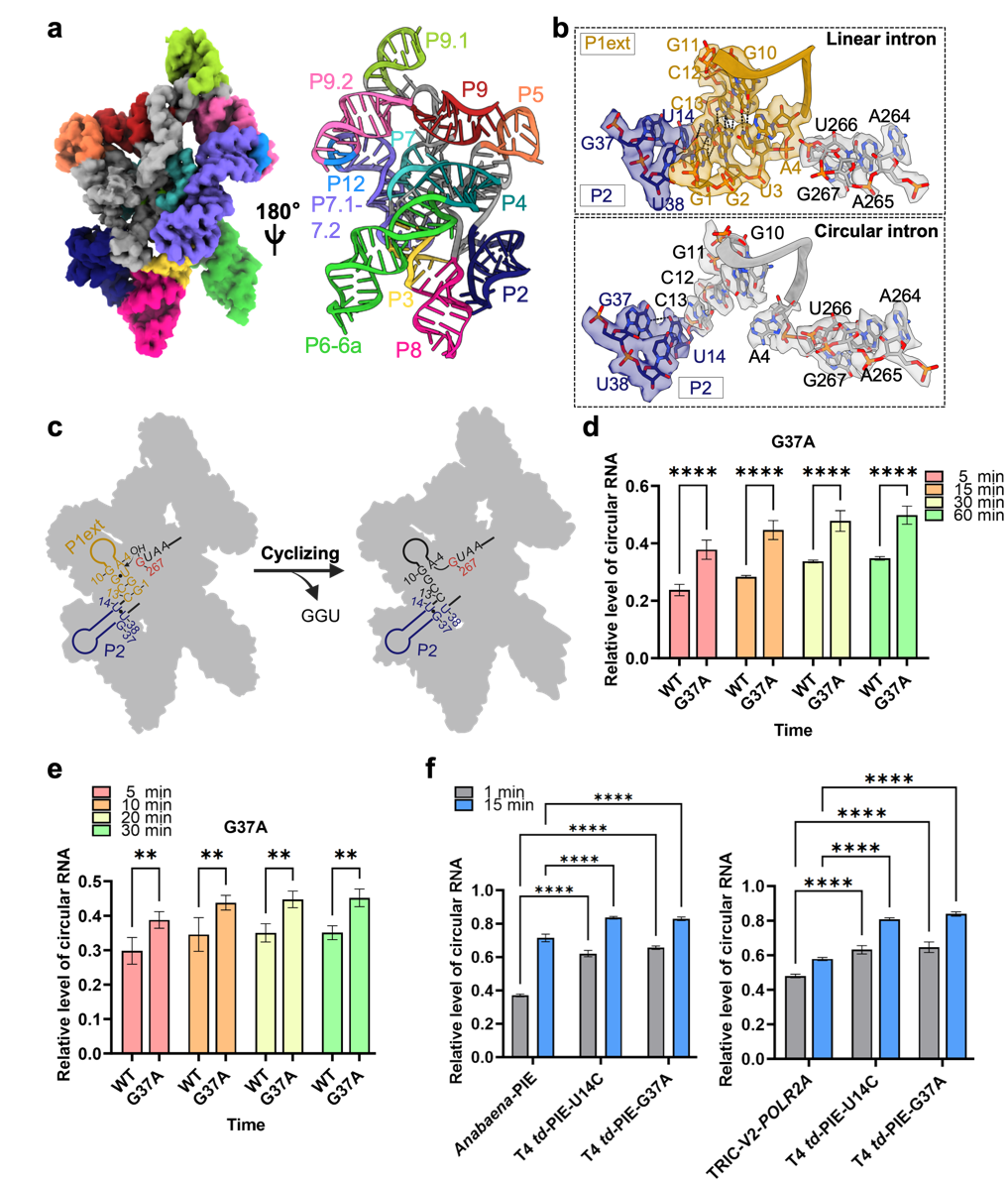
图注:a.环状 T4 td内含子的 3.3 Å 高分辨率冷冻电镜结构;b.线性与环状内含子中P1ext与P2区域的结构对比;c. T4 td内含子环化机制示意图;d. G37A突变显著提升 T4 td内含子的环化效率;e.在T4 td-PIE系统中,G37A 突变促进POLR2A circRNA的高效生成;f.结构指导下优化的T4 td-PIE突变体在环化效率上优于Anabaena-PIE 和 TRIC-V2 系统。
这项工作不仅为理解 RNA环化的分子机制提供了高分辨率结构基础,也为 circRNA的规模化生产与应用提供了可行的工程化方案。研究成果有望加速circRNA在 疫苗研发、RNA药物、合成生物学等领域的应用落地。
该研究工作获得了国家自然科学基金委、科技部、中国科学院先导、合肥大健康研究院等基金项目的资助,以及获得了细胞动力学教育部重点实验室、中国科大冷冻电镜平台及附一院的大力支持。中国科学技术大学生命科学与医学部博士研究生安林凤为第一作者,李珊珊副教授和张凯铭教授为共同通讯作者。
原文链接: https://www.nature.com/articles/s41929-025-01445-z
